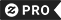Tapez / cliquez sur l'image pour voir plus de RealViewsTM
30,50 €
par t-shirt
T-shirt im non paresseux je juste n'ai pas assez d'enzymes
Qté:
Modèle
T-shirt pour femmes
+6,40 €
+21,80 €
+13,00 €
Couleur & Procédé d'impression
Blanc
Impression classique : sans base blanche
Impression vive : base blanche
+7,55 €
+7,55 €
+7,55 €
+7,55 €
+7,55 €
+7,55 €
+7,55 €
La Promesse Zazzle
Garantie Coup de Coeur
Vous ne l'aimez pas ? Nous le reprenons ! 30 jours pour choisir, notre "Garantie 100% coup de cœur".
Livraison Internationale Simplifiée
Expédition sans soucis, sans frais cachés. Nous couvrons les frais de douane.
Achats Sécurisés Garantis
Paiement 100% sécurisé grâce au cryptage SSL.
A propos de T-shirts
Vendu (e) par
À propos de ce design
T-shirt im non paresseux je juste n'ai pas assez d'enzymes
Les enzymes sont des protéines qui catalysent (c.-à-d., augmentez les taux de) des réactions chimiques. [1] [2] dans des réactions enzymatiques, les molécules au début du processus s'appellent les substrats, et l'enzyme les convertit en différentes molécules, appelées les produits. Presque tous les processus dans une cellule biologique ont besoin d'enzymes pour se produire aux taux significatifs. Puisque les enzymes sont sélectives pour leurs substrats et accélèrent seulement quelques réactions de parmi beaucoup de possibilités, l'ensemble d'enzymes faites dans une cellule détermine quelles voies métaboliques se produisent en cette cellule. Comme tous les catalyseurs, les enzymes fonctionnent à côté d'abaisser l'énergie d'activation (‡ d'ea) pour une réaction, de ce fait considérablement augmentant le taux de la réaction. En conséquence, des produits sont formés plus rapidement et les réactions atteignent leur état d'équilibre plus rapidement. La plupart des taux de réaction enzymique sont des millions de périodes plus rapidement que ceux des réactions ONU-catalysées comparables. Comme avec tous les catalyseurs, des enzymes ne sont pas consommées par les réactions qu'elles catalysent, ni elles changent l'équilibre de ces réactions. Cependant, les enzymes diffèrent de la plupart des autres catalyseurs en étant beaucoup plus spécifiques. Des enzymes sont connues pour catalyser environ 4.000 réactions biochimiques. [3] Quelques molécules d'ARN appelées les ribozymes catalysent également des réactions, à un exemple important étant quelques pièces du ribosome. [4] [5] molécules synthétiques ont appelé les enzymes artificielles montrent également enzyme-comme la catalyse. [6] L'activité enzymatique peut être affectée par d'autres molécules. Les inhibiteurs sont des molécules qui diminuent l'activité enzymatique ; les activateurs sont des molécules qui augmentent l'activité. Beaucoup de drogues et de poisons sont des inhibiteurs d'enzyme. L'activité est également affectée par la température, l'environnement chimique (par exemple, pH), et la concentration du substrat. Quelques enzymes sont employées commercialement, par exemple, dans la synthèse des antibiotiques. En outre, quelques produits de ménage emploient des enzymes pour accélérer des réactions biochimiques (par exemple, les enzymes dans les poudres à laver biologiques décomposent la protéine ou les grosses taches sur des vêtements ; les enzymes dans des attendrisseurs de viande décomposent des protéines, facilitant la viande pour mâcher). Le contenu [peau] 1 structures d'étymologie et d'histoire 2 et spécificité 2.1.1" des mécanismes 2,1 serrure et clé" modèle 2,2 mécanismes 2.2.1 dynamique de la stabilisation 2.2.2 d'état de transition et de la fonction 2,3 les 3 contrôles biologiques allostérique de la fonction 8 de l'inhibition 7 de la cinétique 6 de la thermodynamique 5 des coenzymes 4 de cofacteurs de la modulation et de cofacteurs 3,2 des coenzymes 3,1 de la participation de l'activité 9 dans des conventions de nomination de la maladie 10 11 applications industrielles 12 voient également l'étymologie de 13 des références 14 liens externes davantage de lecture 15 [éditez] et l'histoire Eduard BuchnerAs tôt en tant que 18ème en retard et tôt les 19èmes siècles, la digestion de la viande par les sécrétions d'estomac [7] et la conversion de l'amidon en sucres par les extraits et la salive de plante ont été connus. Cependant, le mécanisme par lequel ceci s'est produit n'avait pas été identifié. [8] Au 19ème siècle, en étudiant la fermentation du sucre à l'alcool par la levure, Louis Pasteur est venu à la conclusion que cette fermentation a été catalysée par une force essentielle contenue dans les cellules de levure appelées les "ferments", qui ont été pensés pour fonctionner seulement dans la matière organique. Il a écrit que "la fermentation alcoolique est un acte corrélé avec la vie et l'organisation des cellules de levure, pas avec la mort ou la putréfaction des cellules. " [9] en 1877, le physiologiste allemand Wilhelm Kühne (1837-1900) avait l'habitude la première fois l'enzyme de terme, qui vient du ενζυμον, "en levain", pour décrire ce processus. [10] L'enzyme de mot a été employée plus tard pour se rapporter aux substances nonliving telles que la pepsine, et le ferment de mot a été employé pour se rapporter à l'activité chimique produite par les organismes vivants. En 1897, Eduard Buchner a soumis son premier papier sur la capacité des extraits de levure qui ont manqué de toutes les cellules de levure vivantes pour fermenter le sucre. Dans une série d'expériences au de Berlin, il a constaté que le sucre a été fermenté même lorsqu'il n'y avait aucune cellule de levure vivante dans le mélange. [11] Il a appelé l'enzyme qui a provoqué la fermentation du saccharose "zymase". [12] En 1907, il a reçu le prix Nobel en chimie "pour sa recherche biochimique et sa découverte de la fermentation sans cellule". Après l'exemple de Buchner, des enzymes sont habituellement appelées selon la réaction qu'elles effectuent. Typiquement, pour produire du nom d'une enzyme, le suffixe - l'ase est ajouté au nom de son substrat (par exemple, la lactase est l'enzyme qui fend le lactose) ou du type de réaction (par exemple, l'ADN polymérase Forme des polymères d'ADN). [13] Après avoir prouvé que les enzymes pourraient fonctionner en dehors d'une cellule vivante, la prochaine étape était de déterminer leur nature biochimique. Beaucoup de premiers travailleurs ont noté que l'activité enzymatique a été associée aux protéines, mais plusieurs scientifiques (tels que Prix Nobel Richard Willstätter) ont argué du fait que les protéines étaient simplement des transporteurs pour les enzymes vraies et que les protéines en soi étaient incapables de la catalyse. Cependant, en 1926, James B. Sumner a prouvé que l'urease d'enzymes était une protéine pure et cristallisé lui ; Sumner a fait de même pour la catalase d'enzymes en 1937. La conclusion que les protéines pures peuvent être des enzymes a été définitivement prouvée par Northrop et Stanley, qui ont travaillées à la pepsine d'enzymes digestives (1930), à la trypsine et à la chymotrypsine. Ces trois scientifiques ont été attribués le prix 1946 Nobel en chimie. [14] Cette découverte que des enzymes pourraient être cristallisées par la suite a permis à leurs structures d'être résolues par la cristallographie de rayon X. C'était premier fait pour le lysozyme, une enzyme trouvée en larmes, la salive et les blancs d'oeuf qui digère l'enrobage de quelques bactéries ; la structure a été résolue par un groupe mené par David Chilton Phillips et édité en 1965. [15] Cette structure à haute résolution de lysozyme a marqué le début du champ de la biologie structurelle et de l'effort de comprendre comment les enzymes fonctionnent à un niveau de précision atomique. [éditez] les structures et les mécanismes voient également : Diagramme de ruban de catalyse d'enzymes montrant l'anhydrase carbonique humaine II. La sphère grise est le cofacteur de zinc dans le site actif. Le diagramme tiré d'APB 1MOO.Enzymes sont généralement les protéines globulaires et s'étendent de juste 62 résidus d'acide aminé dans la taille, pour le monomère du tautomerase de 4 oxalocrotonate, [16] jusqu'plus de 2.500 résidus dans la synthase animale d'acide gras. [17] Un nombre restreint de catalyseurs biologiques basés sur ARN existent, avec être le plus commun le ribosome ; ceux-ci désigné sous le nom des ARN-enzymes ou des ribozymes. Les activités des enzymes sont déterminées par leur structure tridimensionnelle. [18] Cependant, bien que la structure détermine la fonction, la prévision d'une activité enzymatique nouvelle juste de sa structure est un problème très difficile qui n'a pas été encore résolu. [19] La plupart des enzymes sont beaucoup plus grandes que les substrats qu'elles agissent dessus, et seulement une petite partie de l'enzyme (environ 3-4 acides aminés) est directement impliquée dans la catalyse. [20] La région qui contient ces résidus catalytiques, lie le substrat, et puis effectue la réaction est connue comme site actif. Les enzymes peuvent également contenir les sites qui lient les cofacteurs, qui sont nécessaires pour la catalyse. Quelques enzymes ont également les accepteurs pour les petites molécules, qui sont souvent les produits ou les substrats directs ou indirects de la réaction catalysée. Cette attache peut servir à augmenter ou diminuer l'activité enzymatique, prévoir des moyens la régulation par réaction du signal. Comme toutes les protéines, les enzymes sont de longues, linéaires chaînes des acides aminés qui se plient pour fabriquer un produit tridimensionnel. Chaque séquence des acides aminés unique produit une structure spécifique, qui a les propriétés uniques. Les différentes chaînes de protéine peuvent parfois grouper ensemble pour former un complexe de protéine. La plupart des enzymes peuvent être dénaturer-quest, dévoilé et inactiver-par les dénaturants de chauffage ou de produit chimique, qui perturbent la structure tridimensionnelle de la protéine. Selon l'enzyme, la dénaturation peut être réversible ou irréversible. Des structures des enzymes dans le complexe avec des substrats ou les analogues de substrat pendant une réaction peuvent être obtenues suivre des méthodes résolues par temps de cristallographie. [éditez] les enzymes de spécificité sont habituellement très spécifiques quant à quelles réactions elles catalysent et les substrats qui sont impliqués dans ces réactions. La forme complémentaire, la charge et caractéristiques hydrophiles/hydrophobes des enzymes et des substrats sont responsables de cette spécificité. Les enzymes peuvent également montrer les niveaux impressionnants du stereospecificity, du regioselectivity et du chemoselectivity. [21] Certaines des enzymes montrant la spécificité et l'exactitude les plus élevées sont impliquées dans la copie et l'expression du génome. Ces enzymes ont des mécanismes de "correction d'épreuves". Ici, une enzyme telle que l'ADN polymérase Catalyse une réaction dans une première étape et puis des contrôles que le produit est correct dans une deuxième étape. [22] Ce processus de pas de deux a comme conséquence les taux d'erreurs moyens de moins de 1 erreur dans 100 millions de réactions en polymérases mammifères haute-fidélité. [23] Des mécanismes de correction sur épreuves semblables sont également trouvés en ARN polymérase, [24] synthétases de l'aminoacyl ARNt [25] et ribosomes. [26] Quelques enzymes qui produisent les métabolites secondaires sont décrites comme promiscueuses, car elles peuvent agir sur une gamme relativement large de différents substrats. On lui a suggéré que cette large spécificité de substrat soit importante pour l'évolution de nouvelles voies biosynthétiques. [27] [éditez] la "serrure et" les enzymes modèles principales sont très spécifiques, et elle a été proposée par le chimiste organique Emil Fischer de Prix Nobel en 1894 que c'ait été parce que l'enzyme et le substrat possèdent les formes géométriques complémentaires spécifiques qui s'insèrent exactement dans une une autre. [28] Ceci désigné souvent sous le nom "du modèle de serrure et de clé". Cependant, alors que ce modèle explique la spécificité d'enzymes, il n'explique pas la stabilisation du déclarer de transition que les enzymes réalisent. Diagrammes pour montrer l'hypothèse convenable induite de l'action enzymatique. En 1958, Daniel Koshland a proposé une modification au modèle de serrure et principal : puisque les enzymes sont les structures plutôt flexibles, le site actif est continuellement remodelé par des interactions avec le substrat pendant que le substrat agit l'un sur l'autre avec de l'enzyme. [29] En conséquence, le substrat ne lie pas simplement à un site actif rigide ; les chaînes latérales d'acide aminé qui composent le site actif sont moulées dans les positions précises qui permettent à l'enzyme de remplir sa fonction catalytique. Dans certains cas, comme des glycosidases, la molécule de substrat se déforme également légèrement pendant qu'elle entre dans le site actif. [30] Le site actif continue à changer jusqu'à ce que le substrat soit complètement lié, lequel au point la forme et la charge finales est déterminée. [31] L'ajustement induit peut augmenter la fidélité de la reconnaissance moléculaire en présence de la concurrence et du bruit par l'intermédiaire du mécanisme de correction sur épreuves conformationnel. [32] [éditez] les enzymes de mécanismes peuvent agir de plusieurs manières, qui abaissent le ‡ de ΔG : [33] L'abaissement de l'énergie d'activation en créant un environnement dans lequel l'état de transition est stabilisé (par exemple tendant la forme d'a substrat-par lier la conformation de transition-state des molécules de substrat/produit, l'enzyme tord les substrats attachés dans leur forme d'état de transition, réduisant de ce fait la quantité d'énergie exigée pour accomplir la transition). Abaissant l'énergie de l'état de transition, mais sans tordre le substrat, en créant un environnement avec la distribution de charge opposée à celle de l'état de transition. Fourniture d'une voie alternative. Par exemple, temporairement réagissant avec le substrat pour former un complexe intermédiaire d'es, qui serait impossible en l'absence de l'enzyme. En réduisant l'entropie de réaction changez en réunissant des substrats dans l'orientation correcte pour réagir. Considérer le ‡ de ΔH seul donne sur cet effet. Les augmentations des températures accélèrent des réactions. Ainsi, les augmentations de la température aident l'enzyme pour fonctionner et pour développer le produit final encore plus rapidement. Cependant, si heated trop, la forme des enzymes détériore et seulement quand la température revient à la normale fait le regain d'enzymes sa forme. Certaines enzymes comme les enzymes thermolabiles fonctionnent bien à de basses températures. Intéressant, cet effet entropique implique la déstabilisation de l'état fondamental, [34] et sa contribution à la catalyse est relativement petite. [35] [éditez] la stabilisation d'état de transition la compréhension d'origine de la réduction de ‡ de ΔG exige d'on de découvrir comment les enzymes peuvent stabiliser son état de transition davantage que l'état de transition de la réaction uncatalyzed. Apparemment, la plupart de façon efficace pour atteindre la grande stabilisation est l'utilisation des effets électrostatiques, en particulier, en ayant un environnement polaire relativement fixe qui est orienté vers la distribution de charge de l'état de transition. [36] Un tel environnement n'existe pas dans la réaction uncatalyzed dans l'eau. [éditez] la dynamique et la fonction voient également : La dynamique de protéine la dynamique interne des enzymes est liée à leur mécanisme de catalyse. [37] [38] [39] dynamique internes sont le mouvement des parties de la structure des enzymes, telles que différents résidus d'acide aminé, un groupe d'acides aminés, ou même un domaine entier de protéine. Ces mouvements se produisent à de divers calendriers s'étendant des femtosecondes aux secondes. Les réseaux des résidus de protéine dans toute la structure des enzymes peuvent contribuer à la catalyse par des mouvements dynamiques. [40] [41] [42] [43] mouvements de protéine sont essentiels à beaucoup d'enzymes, mais si les petites et rapides vibrations, ou les plus grands et plus lents mouvements conformationnels sont plus importants dépendent du type de réaction impliqué. Cependant, bien que ces mouvements soient importants en liant et en sortant des substrats et des produits, il n'est pas clair si les mouvements de protéine aident à accélérer les étapes chimiques dans des réactions enzymatiques. [44] Ces nouvelles analyses ont également des implications en comprenant des effets allostériques et en développant de nouvelles drogues. [éditez] transition allostérique de modulation allostérique d'une enzyme entre les états de R et de T, stabilisée par un agoniste, un inhibiteur et un article principal de substrat (le modèle de MWC) : Les sites allostériques réglementaires allostériques sont des sites sur l'enzyme qui lient aux molécules dans l'environnement cellulaire. Les sites forment les liens faibles et noncovalent avec ces molécules, causant un changement de la conformation de l'enzyme. Ce changement de conformation traduit au site actif, qui affecte alors le taux de réaction de l'enzyme. [45] Les interactions allostériques peuvent empêcher et activer des enzymes et sont une manière commune que des enzymes sont commandées dans le corps. [46] [éditez] des cofacteurs et des articles principaux de coenzymes : Les cofacteurs de cofacteur (biochimie) et de coenzyme [éditez] quelques enzymes n'ont besoin d'aucun composant supplémentaire pour montrer la pleine activité. Cependant, d'autres exigent des molécules sans protéines appelées les cofacteurs d'être liées pour l'activité. [47] Les cofacteurs peuvent être les composés inorganiques (par exemple, des ions en métal et des groupes de fer-soufre) ou organiques (par exemple, flavin et heme). Les cofacteurs organiques peuvent être l'un ou l'autre groupes prosthétiques, qui sont étroitement liés à une enzyme, ou coenzymes, qui sont sortis du site actif des enzymes pendant la réaction. Les coenzymes incluent le nadh, le NADPH et l'adénosine triphosphate. Ces molécules transfèrent les groupes chimiques entre les enzymes. [48] Un exemple d'une enzyme qui contient un cofacteur est anhydrase carbonique, et est montré dans le diagramme de ruban ci-dessus avec du cofacteur de zinc lié en tant qu'élément de son site actif. [49] Ces molécules étroitement liées sont habituellement trouvées dans le site actif et sont impliquées dans la catalyse. Par exemple, le flavin et les cofacteurs de heme sont souvent impliqués dans des réactions redox. Les enzymes qui exigent un cofacteur mais n'ont pas une limite s'appellent des apoenzymes ou les apoprotéines. Un apoenzyme ainsi que ses cofacteurs s'appelle un holoenzyme (c'est la forme active). La plupart des cofacteurs ne sont pas en covalence attachés à une enzyme, mais sont très étroitement liés. Cependant, des groupes prosthétiques organiques peuvent être en covalence liés (par exemple, pyrophosphate de thiamine dans la déshydrogénase de pyruvate d'enzymes). Le terme "holoenzyme" peut également être appliqué aux enzymes qui contiennent les sous-unités multiples de protéine, telles que les ADN polymérases ; ici le holoenzyme est le complexe complet contenant toutes les sous-unités requises pour l'activité. [éditez] les coenzymes Espace-remplissant modèle du coenzyme NADHCoenzymes sont de petites molécules organiques qui transportent les groupes chimiques d'une enzyme à l'autre. [50] Certains de ces produits chimiques tels que la riboflavine, la thiamine et l'acide folique sont des vitamines (les composés qui ne peuvent pas être synthétisés par le corps et doivent être acquis du régime). Les groupes chimiques portés incluent l'ion d'hydrure (h) porté par NAD ou nadp+, le groupe de phosphate a porté par l'adénosine triphosphate, le groupe d'acétyle porté par le coenzyme A, le formyle, le methenyl ou les groupes méthyliques portés par l'acide folique et le groupe méthylique porté par S-adenosylmethionine. Puisque des coenzymes sont chimiquement changés par suite de l'action enzymatique, il est utile de considérer comme étant des coenzymes une classe spéciale des substrats, ou des deuxièmes substrats, qui sont communs à beaucoup de différentes enzymes. Par exemple, environ 700 enzymes sont connues pour employer le coenzyme nadh. [51] Des coenzymes habituellement sont sans interruption régénérés et leurs concentrations sont maintenues à un niveau régulier à l'intérieur de la cellule : par exemple, le NADPH est régénéré par la voie et le S-adenosylmethionine de phosphate de pentose par adenosyltransferase de méthionine. Cette régénération continue signifie que même un peu de coenzymes sont employés très intensivement. Par exemple, le corps humain retourne son propre poids dans le triphosphate d'adénosine chaque jour. [52] [éditez] thermodynamique les énergies des étapes d'une réaction chimique. Les substrats ont besoin de beaucoup d'énergie pour atteindre un état de transition, qui se délabre alors dans des produits. L'enzyme stabilise l'état de transition, réduisant l'énergie requise pour former des produits. Articles principaux : L'énergie d'activation, l'équilibre thermo-dynamique, et l'équilibre chimique en tant que tous les catalyseurs, enzymes ne changent pas la position de l'équilibre chimique de la réaction. Habituellement, en présence d'une enzyme, la réaction fonctionne dans la même direction qu'elle sans enzyme, juste plus rapidement. Cependant, en l'absence de l'enzyme, autre uncatalyzed possible, des réactions "spontanées" pourrait mener à différents produits, parce qu'en ces conditions ce produit différent est formé plus rapidement. En outre, les enzymes peuvent coupler deux réactions ou plus, de sorte qu'une réaction thermodynamiquement favorable puisse être employée "pour conduire" thermodynamiquement défavorable. Par exemple, l'hydrolyse du triphosphate d'adénosine est employée souvent pour conduire d'autres réactions chimiques. [53] Les enzymes catalysent les réactions en avant et arrière également. Elles ne changent pas l'équilibre lui-même, mais seulement la vitesse à laquelle il est atteint. Par exemple, l'anhydrase carbonique catalyse sa réaction dans l'une ou l'autre direction selon la concentration de ses réactifs. (dans les tissus ; concentration élevée en CO2) (dans des poumons ; la basse concentration en CO2) néanmoins, si l'équilibre est considérablement déplacé dans une direction, c.-à-d., dans une réaction très exergonic, la réaction est effectivement irréversible. Dans ces conditions l'enzyme, en fait, seulement catalysez la réaction dans la direction thermodynamiquement permise. [éditez] article principal de cinétique : Le mécanisme de cinétique d'enzymes pour une enzyme simple de substrat a catalysé la réaction. L'enzyme (e) lie un substrat (s) et produit une cinétique du produit (P).Enzyme est l'enquête sur la façon dont les enzymes lient des substrats et les transforment en produits. Les données de taux utilisées dans des analyses cinétiques sont obtenues à partir des titrages de l'enzyme. En 1902 Victor Henri [54] a proposé une théorie quantitative de cinétique d'enzymes, mais ses données expérimentales n'étaient pas utile parce que l'importance de la concentration d'ions d'hydrogène n'a pas été encore appréciée. Après que Peter Lauritz Sørensen ait défini la pH-échelle logarithmique et présenté le concept de l'amortissement en 1909 [55] le chimiste allemand Leonor Michaelis et son postdoc canadien Maud Leonora Menten ont répété les expériences de Henri et ont confirmé son équation qui désigné sous le nom de la cinétique de Henri-Michaelis-Menten (parfois aussi cinétique de Michaelis-Menten). [56] Leur travail a été encore développé par G.E. Briggs et J.B.S. Haldane, qui ont dérivé les équations cinétiques qui sont encore très utilisées aujourd'hui. [57] La contribution principale de Henri était de penser aux réactions enzymiques dans deux étapes. Dans le premier, le substrat lie réversiblement à l'enzyme, formant le complexe d'enzyme/substrate. Ceci s'appelle parfois le complexe de Michaelis. L'enzyme alors catalyse l'étape chimique dans la réaction et sort le produit. La courbe de saturation pour une réaction enzymique montrant la relation entre la concentration en substrat (s) et le taux (v).Enzymes peut catalyser jusqu'à plusieurs million de réactions par seconde. Par exemple, la décarboxylation uncatalyzed de l'orotidine 5' - le monophosphate a une demi vie de 78 millions d'ans. Cependant, quand l'orotidine 5' d'enzymes - le décarboxylase de phosphate est ajouté, le même processus prend juste 25 millisecondes. [58] Les taux d'enzymes dépendent des états de solution et de la concentration en substrat. Les conditions qui dénaturent la protéine suppriment l'activité enzymatique, telle que des hautes températures, des extrémités du pH ou des concentrations élevées en sel, tout en élevant la concentration en substrat tend à augmenter l'activité. Pour trouver la vitesse maximale d'une réaction enzymatique, la concentration en substrat est augmentée jusqu'à ce qu'un taux constant de formation de produit soit vu. Ceci est montré dans la courbe de saturation du côté droit. La saturation se produit parce que, à mesure que la concentration en substrat augmente, de plus en plus de l'enzyme libre est converti en forme liée par substrat d'es. À la vitesse maximum (Vmax) de l'enzyme, tous les sites à enzymes actives sont liés au substrat, et la quantité de complexe d'es est identique que le montant total de l'enzyme. Cependant, Vmax est seulement une constante cinétique des enzymes. La quantité de substrat requise pour réaliser un taux indiqué de réaction est également importante. Ceci est donné par la constante de Michaelis-Menten (kilomètre), qui est la concentration en substrat exigée pour qu'une enzyme atteigne un demi- de sa vitesse maximum. Chaque enzyme a un kilomètre caractéristique pour un substrat donné, et ceci peut montrer comment fortement l'attache du substrat est à l'enzyme. Une autre constante utile est un kcat, qui est le nombre de molécules de substrat manipulées par un site actif par seconde. L'efficacité d'une enzyme peut être exprimée en termes de kcat/Km. Ceci également s'appelle la spécificité constante et incorpore les constantes de taux pour toutes les étapes dans la réaction. Puisque la constante de spécificité reflète l'affinité et la capacité catalytique, il est utile pour comparer différentes enzymes les uns contre les autres, ou la même enzyme à différents substrats. Le maximum théorique pour la constante de spécificité s'appelle la limite de diffusion et est environ 108 à 109 (M−1 s−1). En ce moment chaque collision de l'enzyme avec son substrat aura comme conséquence la catalyse, et le taux de formation de produit n'est pas limité par le taux de réaction mais par le taux de diffusion. Des enzymes avec cette propriété s'appellent catalytiquement parfaites ou cinétiquement parfaites. L'exemple de telles enzymes sont isomérase de triose-phosphate, anhydrase carbonique, acétylcholinestérase, catalase, fumarase, β-lactamase, et dismutase de superoxyde. La cinétique de Michaelis-Menten se fonde sur la loi de l'action de masse, qui est dérivée des acceptations de la diffusion libre et de la collision aléatoire thermodynamiquement conduite. Cependant, beaucoup de processus biochimiques ou cellulaires dévient de manière significative de ces conditions, en raison de l'encombrement macromoléculaire, de la phase-séparation de l'enzyme/du substrat/du produit, ou d'un ou bidimensionnel mouvement moléculaire. [59] Dans ces situations, une cinétique de Michaelis-Menten de fractale peut être appliquée. [60] [61] [62] [63] quelques enzymes fonctionnent avec la cinétique qui est plus rapide que les taux de diffusion, qui sembleraient être impossibles. Plusieurs mécanismes ont été appelés pour expliquer ce phénomène. Quelques protéines sont censées pour accélérer la catalyse en dessinant leur substrat dedans et pré-en les orientant en employant les champs électriques dipolaires. D'autres modèles appellent une explication quantum-mécanique de perçage d'un tunnel, par lequel un proton ou un électron puisse percer un tunnel par des barrières d'activation, bien que pour le proton le perçage d'un tunnel de ce modèle reste quelque peu controversé. [64] [65] Quantum perçant un tunnel pour des protons a été observé en tryptamine. [66] Ceci suggère que la catalyse d'enzymes puisse plus exactement être caractérisée comme "par la barrière" plutôt que le modèle traditionnel, qui exige des substrats de passer "par-dessus" une barrière abaissée d'énergie. [éditez] les inhibiteurs concurrentiels d'inhibition lient réversiblement à l'enzyme, empêchant l'attache du substrat. D'autre part, lier du substrat empêche lier de l'inhibiteur. Le substrat et l'inhibiteur concurrencent pour l'enzyme. Types d'inhibition. Cette classification a été présentée par W.W. Cleland. [67] Article principal : Des taux de réaction enzymique d'inhibiteur d'enzyme peuvent être diminués par de divers types d'inhibiteurs d'enzyme. L'inhibition concurrentielle dans l'inhibition concurrentielle, l'inhibiteur et le substrat concurrencent pour l'enzyme (c.-à-d., elles ne peuvent pas lier en même temps). [68] Les inhibiteurs souvent concurrentiels ressemblent fortement au vrai substrat de l'enzyme. Par exemple, le méthotrexate est un inhibiteur concurrentiel de la réductase de dihydrofolate d'enzymes, qui catalyse la réduction de dihydrofolate au tetrahydrofolate. La similitude entre les structures de l'acide folique et cette drogue sont montrées dans le chiffre au bon fond. Notez que lier de l'inhibiteur n'a pas besoin d'être à l'accepteur de substrat (comme fréquemment indiqué), si lier de l'inhibiteur change la conformation de l'enzyme pour empêcher l'attache de substrat et vice versa. Dans l'inhibition concurrentielle la vitesse maximale de la réaction n'est pas changée, mais des concentrations plus élevées en substrat sont exigées pour atteindre une vitesse donnée, augmentant le kilomètre apparent. Inhibition non compétitive dans l'inhibition non compétitive que l'inhibiteur ne peut pas lier à l'enzyme libre, mais seulement au l'Es-complexe. L'EIS-complexe formé ainsi est enzymatiquement inactif. Ce type d'inhibition est rare, mais peut se produire en enzymes multimeric. Les inhibiteurs non-compétitifs d'inhibition non-compétitive peuvent lier à l'enzyme en même temps que le substrat, c.-à-d. ils ne lient jamais au site actif. Les complexes d'E-I et d'EIS sont enzymatiquement inactifs. Puisque l'inhibiteur ne peut pas être conduit par l'enzyme par une concentration plus élevée en substrat (contrairement à l'inhibition concurrentielle), le Vmax apparent change. Mais parce que le substrat peut encore lier à l'enzyme, le kilomètre reste la même chose. L'inhibition mélangée ce type d'inhibition ressemble au non-compétitif, sauf que l'EIS-complexe a l'activité enzymatique résiduelle. En beaucoup d'inhibiteurs d'organismes peut agir en tant qu'élément d'un mécanisme de rétroaction. Si une enzyme produit trop d'une substance dans l'organisme, cette substance peut agir en tant qu'inhibiteur pour l'enzyme au début de la voie qui le produit, faisant ralentir ou arrêter la production de la substance quand il y a quantité suffisante. C'est une forme de rétroaction négative. Les enzymes qui sont sujettes à cette forme de règlement sont souvent multimeric et ont les accepteurs allostériques pour les substances de réglementation. Leur le substrat/complots de vitesse ne sont pas hyperbolar, mais sigmoïdaux (en forme de s).
Traduction automatique
Store
Avis des clients
4.7 sur 5 étoiles95 Nombres de Commentaires
95 Commentaires
Avis sur des produits similaires
5 sur 5 étoiles
Par Sylvie L.9 mai 2025 • Achat sécurisé
T-shirt pour femmes, Bleu royal, Adulte M
Avis du créateur
Très contente. J'aime beaucoup la couleur.
5 sur 5 étoiles
Par L.3 février 2020 • Achat sécurisé
T-shirt Slim Fit pour femme BELLA+CANVAS, Noir, Adulte L
Programme d'évaluation de Zazzle
Tee shirt de bonne matière, de bonne qualité, agréable à porter.
Très jolie dessin.
J'en ai fais un cadeau et ça a beaucoup plu. Très bonne impression
très jolie dessin
Belles couleurs
5 sur 5 étoiles
Par Barbier F.14 juin 2025 • Achat sécurisé
T-shirt pour femmes, Blanc, Adulte L
Bonjour, je recommanderais sans hésitation. Il était de très bonne qualité et il a fait l'effet escompté encore merci pour tout ❤️ tout était parfait 👍👌.
Tags
Autres infos
Identification produit : 235136738702665944
Créé le : 11/10/2010 22:07
Note : G
Articles vus récemment