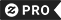Tapez / cliquez sur l'image pour voir plus de RealViewsTM
Les parties en cuir sont simulées par le design. Il n'y aura pas de cuir sur ce produit.
8,30 €
par porte-clé
Porte-clés Je parle de la nomenclature de chimie de l'IUPAC
Qté:
Modèle
Cercle en aluminium
+0,70 €
+0,70 €
+17,95 €
+17,95 €
La Promesse Zazzle
Garantie Coup de Coeur
Vous ne l'aimez pas ? Nous le reprenons ! 30 jours pour choisir, notre "Garantie 100% coup de cœur".
Livraison Internationale Simplifiée
Expédition sans soucis, sans frais cachés. Nous couvrons les frais de douane.
Achats Sécurisés Garantis
Paiement 100% sécurisé grâce au cryptage SSL.
A propos de Porte-clés
Vendu (e) par
À propos de ce design
Les parties en cuir sont simulées par le design. Il n'y aura pas de cuir sur ce produit.
Porte-clés Je parle de la nomenclature de chimie de l'IUPAC
Chimie (d'arabe : chaîne de caractères latinés : chem (kēme), signifiant "valeur") est la science de la matière et les changements qu'elle subit. La science de la matière est également abordée par la physique, mais si la physique adopte une approche plus générale et fondamentale, la chimie est plus spécialisée, se souciant de la composition, du comportement, de la structure et des propriétés de la matière, ainsi que des changements qu'elle subit au cours des réactions chimiques. Il s'agit d'une science physique pour les études de divers atomes, molécules, cristaux et autres agrégats de matière, que ce soit en isolement ou en combinaison, qui incorpore les concepts d'énergie et d'entropie par rapport à la spontanéité des processus chimiques. Les disciplines de la chimie sont traditionnellement regroupées par type de matière étudiée ou par type d'étude. Il s'agit notamment de la chimie inorganique, de l'étude de la matière inorganique, de la chimie organique, de l'étude de la matière organique, de la biochimie, de l'étude des substances trouvées dans les organismes biologiques, de la chimie physique, des études énergétiques des systèmes chimiques à des échelles macroscopiques, moléculaires et infroléculaires, de la chimie analytique, de l'analyse d'échantillons de matériaux pour mieux comprendre leur composition et leur structure chimiques. De nombreuses disciplines plus spécialisées sont apparues ces dernières années, par exemple la neurochimie l'étude chimique du système nerveux (voir sous-disciplines). Résumé La chimie est l'étude scientifique de l'interaction de substances chimiques qui sont constituées d'atomes ou de particules subatomiques : protons, électrons et neutrons. Les atomes se combinent pour produire des molécules ou des cristaux. La chimie est souvent appelée "la science centrale" parce qu'elle relie les autres sciences naturelles comme l'astronomie, la physique, la science matérielle, la biologie et la géologie. La genèse de la chimie peut être attribuée à certaines pratiques, connues sous le nom d'alchimie, qui avaient été pratiquées pendant plusieurs millénaires dans différentes parties du monde, en particulier le Moyen-Orient. La structure des objets que nous utilisons couramment et les propriétés de la matière avec laquelle nous interagissons couramment sont une conséquence des propriétés des substances chimiques et de leurs interactions. Par exemple, l'acier est plus dur que le fer parce que ses atomes sont liés ensemble dans un réseau cristallin plus rigide; le bois brûle ou subit une oxydation rapide parce qu'il peut réagir spontanément avec l'oxygène dans une réaction chimique au-dessus d'une certaine température; le sucre et le sel se dissolvent dans l'eau parce que leurs propriétés moléculaires/ioniques sont telles que la dissolution est préférée dans les conditions ambiantes. Les transformations qui sont étudiées en chimie sont le résultat d'une interaction soit entre différentes substances chimiques, soit entre la matière et l'énergie. La chimie traditionnelle consiste à étudier les interactions entre les substances dans un laboratoire de chimie à l'aide de diverses formes de verrerie de laboratoire. Laboratoire, Institut de biochimie de Cologne Une réaction chimique est une transformation de certaines substances en une ou plusieurs autres substances. Il peut être représenté symboliquement par une équation chimique. Le nombre d'atomes à gauche et à droite dans l'équation pour une transformation chimique est le plus souvent égal. La nature des réactions chimiques qu'une substance peut subir et les changements d'énergie qui peuvent l'accompagner sont limités par certaines règles de base, appelées lois chimiques. L'énergie et l'entropie sont invariablement importantes dans presque toutes les études chimiques. Les substances chimiques sont classées en fonction de leur structure, de leur phase ainsi que de leur composition chimique. Ils peuvent être analysés à l'aide d'outils d'analyse chimique, par exemple la spectroscopie et la chromatographie. La chimie fait partie intégrante du programme d'études scientifiques tant au lycée qu'au début. À ces niveaux, on l'appelle souvent la "chimie générale" qui est une introduction à une grande variété de concepts fondamentaux qui permettent à l'étudiant d'acquérir des outils et des compétences utiles aux niveaux avancés, où la chimie est invariablement étudiée dans l'une de ses diverses sous-disciplines. Les scientifiques, engagés dans la recherche chimique sont connus comme chimistes. La plupart des chimistes se spécialisent dans une ou plusieurs sous-disciplines. Histoire Les anciens Egyptiens ont été les pionniers de l'art de la chimie synthétique "humide" il y a 4000 ans. Vers 1000 avant JC, les civilisations anciennes utilisaient des technologies qui formaient la base des diverses branches de la chimie, comme : extraire le métal de leurs minerais, fabriquer des poteries et des glaçures, fermenter la bière et le vin, fabriquer des pigments pour les cosmétiques et la peinture, extraire des produits chimiques des plantes pour la médecine et le parfum, fabriquer du fromage, du tissu mourant, du cuir tannage, transformer la graisse en savon, faire du verre, du verre, du verre, du verre, du verre, et des alliages. La genèse de la chimie peut être attribuée au phénomène largement observé de la combustion qui a conduit à la métallurgie - l'art et la science de la transformation des minerais pour obtenir des métaux (par exemple la métallurgie dans l'Inde antique). La cupidité pour l'or a conduit à la découverte du processus de purification, même si les principes sous-jacents n'étaient pas bien compris - on pensait qu'il s'agissait d'une transformation plutôt que d'une purification. De nombreux chercheurs de l'époque pensaient qu'il était raisonnable de croire qu'il existe des moyens de transformer des métaux moins chers (de base) en or. Cela a cédé la place à l'alchimie et à la recherche de la Pierre du Philosophe qui était supposée apporter une telle transformation par un simple atomisme tactile remonte à 440 av. J.-C., comme cela pourrait être indiqué par le livre De Rerum Natura (La Nature des choses) écrit par le Lucretiusin romain 50 avant JC. Une grande partie du développement précoce des méthodes de purification est décrite par Pliny l'Ancien dans son Naturalis Historia. Voici un aperçu provisoire : 1. L'alchimie égyptienne [3000 avant J.-C. - 400 avant J.-C.], formule les premières théories de l'"élément" comme l'Ogdoad. 2 alchimie [332 avant JC - 642 après JC], le roi Alexandre le Grand conquiert l'Egypte et fonde Alexandrie, ayant la plus grande bibliothèque du monde, où les savants et les sages se réunissent pour étudier. 3. L'alchimie arabe [642 CE - 1200], la conquête musulmane de l'Égypte (principalement Alexandrie); le développement de la méthode scientifique par Alhazen et Jābir ibn Hayyān révolutionnent le domaine de la chimie. 4. La Maison de Wisdom (Arabe : Collection de produits chimiques Bait ; Hikma), Al-Andalus (Arabe :) et Alexandria (Arabe : Branche de la chimie ) et Alexandria (Arabe : Branche de la chimie) deviennent les principales institutions mondiales où les scientifiques de tous les arrière - plans religieux et ethniques travaillaient ensemble en harmonie élargissant les domaines de la chimie dans un temps connu sous le nom d'âge d'or islamique. 5. Jābir ibn Hayyān, al-Kindi, al-Razi, al-Biruni et Alhazen continuent de dominer le domaine de la chimie, de la maîtriser et d'élargir les limites de la connaissance et de l'expérimentation. 6. Alchimie européenne [1300 - aujourd'hui], Pseudo-Geber s'appuie sur la chimie arabe. 7. Chimie [1661], Boyle écrit son texte de chimie classique The Skeptical Chymist. 8. Chimie [1787], Lavoisier écrit ses éléments classiques de chimie. 9. Chimie [1803], Dalton publie sa Théorie atomique. Les premiers pionniers de la chimie, et inventeurs de la méthode scientifique moderne, étaient des érudits médiévaux arabes et persans. Ils introduisirent une observation précise et une expérimentation contrôlée sur le terrain et découvrirent de nombreuses substances chimiques.[14] "La chimie en tant que science fut presque créée par les musulmans ; car dans ce domaine, où les Grecs (pour autant que nous le sachions) étaient confinés à l'expérience industrielle et à une vague hypothèse, les Saracens introduisirent une observation précise, des expériences contrôlées et des enregistrements minutieux. Ils ont inventé et baptisé l'alembic (al-anbiq), analysé chimiquement d'innombrables substances, composé des lapidaires, des alcalis distingués et des acides, étudié leurs affinités, étudié et fabriqué des centaines de médicaments. L'alchimie, dont les musulmans ont hérité d'Egypte, a contribué à la chimie par un millier de découvertes fortuites, et par sa méthode, qui a été la plus scientifique de toutes les opérations médiévales." Les chimistes musulmans les plus influents étaient Jābir ibn Hayyān (d. 815), al-Kindi (d. 873), al-Razi (d. 925), al-Biruni (d. 1048) et Alhazen (d. 1039). Les oeuvres de Jābir sont devenues plus connues en Europe grâce aux traductions latines d'un pseudo-Geber au 14ème siècle en Espagne, qui a aussi écrit certains de ses propres livres sous le nom de plume "Geber". La contribution des alchimistes et métallurgistes indiens au développement de la chimie a également été très importante. L'émergence de la chimie en Europe était principalement due à l'incidence récurrente de la peste et des fléaux qui s'y trouvaient pendant les temps sombres. Cela a donné lieu à un besoin de médicaments. On pensait qu'il existe un médicament universel appelé l'Elixir de Vie qui peut guérir toutes les maladies, mais comme la Pierre du Philosophe, il n'a jamais été trouvé. Pour certains praticiens, l'alchimie était une poursuite intellectuelle, au fil du temps, ils s'en sont mieux sortis. Paracelsus (1493-1541), par exemple, a rejeté la théorie des 4 éléments et avec seulement une vague compréhension de ses produits chimiques et de ses médicaments, a formé un hybride d'alchimie et de science dans ce qui devait être appelé iatrochimie. De même, les influences de philosophes comme Sir Francis Bacon (1561-1626) et René Descartes (1596-1650), qui exigeaient plus de rigueur en mathématiques et en éliminant les préjugés des observations scientifiques, ont conduit à une révolution scientifique. En chimie, cela a commencé avec Robert Boyle (1627-1691), qui a trouvé une équation connue sous le nom de Boyle's Law sur les caractéristiques de l'état gazeux. En effet, la chimie est arrivée à l'âge d'Antoine Lavoisier (1743-1794), a développé la théorie de la conservation de la masse en 1783; et le développement de la théorie atomique par John Dalton vers 1800. La Loi de Conservation de Masse a abouti à la reformulation de la chimie basée sur cette loi et la théorie de l'oxygène de la combustion, qui était largement basé sur le travail de Lavoisier. Les contributions fondamentales de Lavoisier à la chimie sont le résultat d'un effort conscient pour intégrer toutes les expériences dans le cadre d'une théorie unique. Il a établi l'utilisation constante de la balance chimique, utilisé l'oxygène pour renverser la théorie du phlogiston, et développé un nouveau système de nomenclature chimique et a contribué au système métrique moderne. Lavoisier a également travaillé à traduire le langage archaïque et technique de la chimie en quelque chose qui pouvait être facilement compris par les masses largement incultes, ce qui a conduit à un intérêt public accru pour la chimie. Toutes ces avancées en chimie ont conduit à ce qu'on appelle généralement la révolution chimique. Les contributions de Lavoisier ont conduit à ce qu'on appelle aujourd'hui la chimie moderne, la chimie qui est étudiée dans les établissements d'enseignement du monde entier. C'est à cause de ces contributions et d'autres que Antoine Lavoisier est souvent célébré comme le "Père de la chimie moderne"[18]. La découverte plus tard de Friedrich Wöhler que de nombreuses substances naturelles, composés organiques, peuvent en effet être synthétisés dans un laboratoire de chimie a également aidé la chimie moderne à mûrir à partir de son enfance. La découverte des éléments chimiques a une longue histoire depuis l'époque de l'alchimie et aboutit à la découverte du tableau périodique des éléments chimiques par Dmitri Mendeleev (1834-1907) et à des découvertes ultérieures de certains éléments synthétiques. Etymologie Article principal : Chimie (étymologie) Le mot chimie vient de l'étude antérieure de l'alchimie, qui est un ensemble de pratiques qui englobe des éléments de la chimie, de la métallurgie, de la philosophie, de l'astrologie, de l'astronomie, du mysticisme et de la médecine. L'alchimie à son tour est dérivée du mot arabe "littérature", qui signifie "valeur", est communément considéré comme la quête pour transformer le plomb ou un autre matériel de départ commun en or[21]. Cette relation linguistique entre la recherche de valeur et l'alchimie est considérée comme ayant des origines égyptiennes. Beaucoup pensent que le mot arabe "alchimie" est dérivé du mot Chemi ou Kimi, qui est l'ancien nom de l'Egypte en égyptien.[22][23][24] Le mot a été emprunté par les Grecs, et par les Grecs par les Arabes quand ils ont occupé Alexandrie (Egypte) au 7ème siècle. Les Arabes ont ajouté l'article arabe défini "al" au mot, ce qui a donné le mot (al-kīmiyā). Ainsi, un alchimiste a été appelé un "chimiste" dans le discours populaire, et plus tard le suffixe "ry" a été ajouté à cela pour décrire l'art du chimiste comme "chimie". Définitions Rétrospectivement, la définition de la chimie semble invariablement changer par décennie, à mesure que de nouvelles découvertes et théories ajoutent à la fonctionnalité de la science. Voici quelques-unes des définitions normalisées utilisées par divers chimistes : ・ Alchimie (330) - étude de la composition des eaux, du mouvement, de la croissance, de l'emboîtement, de la désintégration, du dessin des esprits des corps et du collage des esprits dans les corps (Zosimos). ・ Chymistry (1661) - sujet des principes matériels des corps mixtes (Boyle). ・ Chymistry (1663) - un art scientifique, par lequel on apprend à dissoudre des corps, à en tirer les différentes substances sur leur composition, et comment les unir à nouveau, et à les exalter à une perfection supérieure (Glaser). ・ Chimie (1730) - l'art de résoudre les corps mélangés, composés ou agrégés dans leurs principes; et de composer ces corps à partir de ces principes (Stahl). ・ Chimie (1837) - la science qui s'intéresse aux lois et aux effets des forces moléculaires (Dumas). ・ Chimie (1947) - la science des substances : leur structure, leurs propriétés et les réactions qui les transforment en d'autres substances (Pauling). ・ Chimie (1998) - l'étude de la matière et des changements qu'elle subit (Chang). Concepts de base Plusieurs concepts sont essentiels à l'étude de la chimie; certains d'entre eux sont : Atom Article principal : Atom Un atome est l'unité de base de la chimie. Il se compose d'un noyau chargé positivement (le noyau atomique) qui contient des protons et des neutrons, et qui maintient un certain nombre d'électrons pour équilibrer la charge positive dans le noyau. L'atome est aussi la plus petite entité qui peut être envisagée pour conserver certaines des propriétés chimiques de l'élément, telles que l'électronique, le potentiel d'ionisation, les états d'oxydation préférentiels, le numéro de coordination et les types préférés de liaisons à former (p. ex. métallique, ionique, covalente). Élément Article principal : Élément chimique Le concept d'élément chimique est lié à celui de substance chimique. Un élément chimique est caractérisé par un nombre particulier de protons dans les noyaux de ses atomes. Ce numéro est appelé numéro atomique de l'élément. Par exemple, tous les atomes avec 6 protons dans leurs noyaux sont des atomes de carbone de l'élément chimique, et tous les atomes avec 92 protons dans leurs noyaux sont des atomes de l'élément uranium. 94 éléments chimiques ou types d'atomes différents basés sur le nombre de protons existent naturellement. L'UICPA a reconnu 18 autres comme étant artificiellement existantes seulement. Bien que tous les noyaux de tous les atomes appartenant à un élément auront le même nombre de protons, ils peuvent ne pas avoir nécessairement le même nombre de neutrons, de tels atomes sont appelés isotopes. En fait, plusieurs isotopes d'un élément peuvent exister. La présentation la plus pratique des éléments chimiques se trouve dans le tableau périodique des éléments chimiques, qui regroupe les éléments par numéro atomique. En raison de son agencement ingénieux, des groupes ou des colonnes, ainsi que des périodes ou des rangées d'éléments de la table, partagent plusieurs propriétés chimiques, ou suivent une certaine tendance dans des caractéristiques telles que le rayon atomique, l'électronique, etc. Des listes des éléments par nom, par symbole et par numéro atomique sont également disponibles. Composé principal : Composé chimique Un composé est une substance ayant un rapport particulier d'atomes d'éléments chimiques particuliers qui détermine sa composition, et une organisation particulière qui détermine les propriétés chimiques. Par exemple, l'eau est un composé contenant de l'hydrogène et de l'oxygène dans le rapport de deux à un, avec l'atome d'oxygène entre les deux atomes d'hydrogène, et un angle de 104,5° entre eux. Les composés sont formés et interconvertis par des réactions chimiques. Substance Article principal : Substance chimique Une substance chimique est une sorte de matière dont la composition et les propriétés sont définies[33]. Strictement parlant, un mélange de composés, d'éléments ou de composés et d'éléments n'est pas une substance chimique, mais il peut être appelé un produit chimique. La plupart des substances que nous rencontrons dans notre vie quotidienne sont une sorte de mélange, par exemple : air, alliages, biomasse, etc. La nomenclature des substances est une partie essentielle du langage de la chimie. Il s'agit généralement d'un système de dénomination des composés chimiques. Plus tôt dans l'histoire des substances chimiques ont été baptisées par leur découvreur, ce qui a souvent conduit à une certaine confusion et à des difficultés. Cependant, aujourd'hui, le système de nomenclature chimique UICPA permet aux chimistes de spécifier par nom des composés spécifiques parmi la grande variété de produits chimiques possibles. La nomenclature standard des substances chimiques est établie par l'Union internationale de chimie pure et appliquée (UICPA). Il existe des systèmes bien définis pour désigner les espèces chimiques. Les composés organiques sont nommés selon le système de nomenclature organique[34]. Les composés inorganiques sont nommés selon le système de nomenclature inorganique[35]. En outre, le Chemical Abstracts Service a mis au point une méthode d'indexation des substances chimiques. Dans ce schéma, chaque substance chimique est identifiable par un numéro connu sous le nom de numéro d'enregistrement CAS. Molécule Article principal : Molécule Une molécule est la plus petite partie indivisible, en plus d'un atome, d'une substance chimique pure qui a son ensemble unique de propriétés chimiques, c'est-à-dire son potentiel à subir un certain ensemble de réactions chimiques avec d'autres substances. Les molécules peuvent exister sous forme d'unités neutres électriquement contrairement aux ions. Les molécules sont généralement un ensemble d'atomes reliés entre eux par des liaisons covalentes, de sorte que la structure est électriquement neutre et que tous les électrons de valence sont jumelés à d'autres électrons soit en liaisons, soit en paires solitaires. Une structure moléculaire décrit les liens et les positions relatives des atomes dans une molécule telle que celle du Paclitaxel présentée ici L'une des principales caractéristiques d'une molécule est sa géométrie souvent appelée sa structure. Si la structure des molécules diatomiques, triatomiques ou tétra atomiques peut être triviale (linéaire, pyramidal angulaire, etc.), la structure des molécules polyatomiques, qui sont constituées de plus de six atomes (de plusieurs éléments) peut être cruciale pour sa nature chimique. Mole Article principal : Mole (unité) Une mole est la quantité d'une substance qui contient autant d'entités élémentaires (atomes, molécules ou ions) qu'il y a d'atomes dans 0,012 kilogramme (ou 12 grammes) de carbone-12, où les atomes de carbone-12 ne sont pas liés, au repos et dans leur état fondamental[36]. Ce nombre est connu sous le nom de constante Avogadro et est déterminé empiriquement. La valeur actuellement acceptée est 6.02214179(30) × 1023 mol-1 (CODATA 2007). La meilleure façon de comprendre le sens du terme "mole" est de le comparer à des termes tels que des douzaines. Comme une douzaine est égale à 12, une mole est égale à 6.02214179(30) × 1023. Le terme est utilisé parce qu'il est beaucoup plus facile de dire, par exemple, 1 mole d'atomes de carbone, qu'il est à dire 6.02214179(30) × 1023 atomes de carbone. De même, nous pouvons décrire le nombre d'entités comme un multiple ou une fraction de 1 mole, par exemple 2 mole ou 0,5 mole. La taupe est un nombre absolu (sans unité) et peut décrire n'importe quel type d'objet élémentaire, bien que son utilisation se limite généralement à la mesure de structures subatomiques, atomiques et moléculaires. Le nombre de moles d'une substance dans un litre d'une solution est connu comme sa molarité. La molarité est l'unité commune utilisée pour express la concentration d'une solution en chimie physique. Ions et sels Article principal : Ion Un ion est une espèce chargée, un atome ou une molécule, qui a perdu ou gagné un ou plusieurs électrons. Les cations chargés positivement (p. ex. Na+ du cation de sodium) et les anions chargés négativement (p. ex. Cl- du chlorure) peuvent former un réseau cristallin de sels neutres (p. ex. NaCl du chlorure de sodium). Des exemples d'ions polyatomiques qui ne se divisent pas pendant les réactions acides-base sont l'hydroxyde (OH-) et le phosphate (PO43-). Les ions en phase gazeuse sont souvent appelés plasma. Acidité et basicité Article principal : Acide Une substance peut souvent être classée comme acide ou base. Cela se fait souvent sur la base d'un type particulier de réaction, à savoir l'échange de protons entre des composés chimiques. Cependant, un prolongement à ce mode de classification a été brassé par le chimiste américain Gilbert Newton Lewis; dans ce mode de classification, la réaction ne se limite pas à celles qui se produisent en solution aqueuse, ce qui ne se limite plus aux solutions dans l'eau. Selon le concept selon Lewis, les choses cruciales échangées sont les charges Il existe plusieurs autres façons de classer une substance comme acide ou base, comme le montre l'histoire de ce concept Phase Article principal : Phase (matière) Outre les propriétés chimiques spécifiques qui distinguent différentes classifications chimiques, les substances chimiques peuvent exister en plusieurs phases. Pour la plupart, les classifications chimiques sont indépendantes de ces classifications de phases en vrac; cependant, certaines phases plus exotiques sont incompatibles avec certaines propriétés chimiques. Une phase est un ensemble d'états d'un système chimique qui ont des propriétés structurales en vrac semblables, dans une gamme de conditions, comme la pression ou la température. Les propriétés physiques, telles que la densité et l'indice de réfraction, ont tendance à se situer dans les valeurs caractéristiques de la phase. La phase de matière est définie par la transition de phase, c'est-à-dire lorsque l'énergie mise dans le système ou retirée du système entre dans la réorganisation de la structure du système, au lieu de changer les conditions de vrac. Parfois, la distinction entre les phases peut être continue au lieu d'avoir une frontière discrète, dans ce coque la question est considérée comme étant dans un état supercritique. Lorsque trois États se réunissent en fonction des conditions, il s'agit d'un triple point et comme il est invariant, c'est un moyen pratique de définir un ensemble de conditions. Les exemples les plus connus de phases sont les solides, les liquides et les gaz. De nombreuses substances présentent plusieurs phases solides. Par exemple, il y a trois phases de fer solide (alpha, gamma et delta) qui varient en fonction de la température et de la pression. Une différence principale entre les phases solides est la structure cristalline, ou arrangement, des atomes. Une autre phase communément rencontrée dans l'étude de la chimie est la phase aqueuse, qui est l'état des substances dissoutes en solution aqueuse (c'est-à-dire dans l'eau). Les phases moins familières comprennent les plasmas, les condensats Bose-Einstein et les condensats fermioniques ainsi que les phases paramagnétique et ferromagnétique des matériaux magnétiques. Alors que la plupart des phases familières concernent les systèmes tridimensionnels, il est également possible de définir des analogues dans les systèmes bidimensionnels, qui a reçu de l'attention pour sa pertinence pour les systèmes en biologie. Redox Article principal : Redox C'est un concept lié à la capacité des atomes de diverses substances à perdre ou à gagner des électrons. Les substances qui ont la capacité d'oxyder d'autres substances sont considérées comme oxydatives et sont connues sous le nom d'agents oxydants, d'oxydants ou d'oxydants. Un oxydant élimine les électrons d'une autre substance. De même, les substances qui ont la capacité de réduire d'autres substances sont considérées comme réductrices et sont connues sous le nom d'agents réducteurs, réducteurs ou réducteurs. Un réducteur transfère les électrons vers une autre substance, et est donc oxydé. Et parce qu'il "donne" des électrons, il est aussi appelé donneur d'électrons. L'oxydation et la réduction font bien référence à un changement de numéro d'oxydation — le transfert réel d'électrons peut ne jamais se produire. Ainsi, l'oxydation est mieux définie comme une augmentation du nombre d'oxydation, et la réduction comme une diminution du nombre d'oxydation. Liaison Électronique et orbitales moléculaires On dit que les atomes collant ensemble dans des molécules ou des cristaux sont liés les uns aux autres. Une liaison chimique peut être visualisée comme équilibre multipolaire entre les charges positives dans les noyaux et les charges négatives qui oscillent autour d'eux. Plus qu'une simple attraction et une simple répulsion, les énergies et les distributions caractérisent la disponibilité d'un électron pour se lier à un autre atome. Une liaison chimique peut être soit une liaison covalente, une liaison ionique, une liaison hydrogène ou simplement à cause de la force de Van der Waals. Chacun de ces types de liens est attribué à un potentiel. Ces potentiels créent les interactions qui maintiennent les atomes ensemble dans des molécules ou des cristaux. Dans de nombreux composés simples, Valence Bond Theory, Valence Shell Electron Pair Repulsion model (VSEPR) et le concept de numéro d'oxydation peuvent être utilisés pour expliquer la structure moléculaire et la composition. De même, les théories de la physique classique peuvent être utilisées pour prédire de nombreuses structures ioniques. Avec des composés plus complexes, comme les complexes métalliques, la théorie des liaisons de valence est moins applicable et des approches alternatives, comme la théorie de l'orbitale moléculaire, sont généralement utilisées. Voir le diagramme sur les orbitales électroniques. Réaction Article principal : Réaction chimique Lorsqu'une substance chimique est transformée par suite de son interaction avec une autre ou une autre énergie, une réaction chimique est dite s'être produite. La réaction chimique est donc un concept lié à la "réaction" d'une substance lorsqu'elle est en contact étroit avec une autre substance, que ce soit sous forme de mélange ou de solution, d'exposition à une certaine forme d'énergie, ou les deux. Il en résulte un échange d'énergie entre les constituants de la réaction ainsi qu'avec l'environnement du système qui peut être un bâtiment conçu qui est souvent des verreries de laboratoire. Les réactions chimiques peuvent entraîner la formation ou la dissociation de molécules, c'est-à-dire des molécules se décomposant pour former deux ou plusieurs molécules plus petites, ou le réarrangement d'atomes à l'intérieur ou à travers des molécules. Les réactions chimiques impliquent généralement la fabrication ou la rupture de liaisons chimiques. L'oxydation, la réduction, la dissociation, la neutralisation acide-base et le réarrangement moléculaire sont quelques-uns des types de réactions chimiques couramment utilisés. Une réaction chimique peut être représentée symboliquement par une équation chimique. Alors que dans une réaction chimique non nucléaire, le nombre et le type d'atomes des deux côtés de l'équation sont égaux, pour une réaction nucléaire cela ne vaut que pour les particules nucléaires, à savoir les protons et les neutrons. La séquence des étapes dans lesquelles la réorganisation des liaisons chimiques peut se produire au cours d'une réaction chimique est appelée son mécanisme. Une réaction chimique peut être envisagée en plusieurs étapes, dont chacune peut avoir une vitesse différente. De nombreux intermédiaires de réaction à stabilité variable peuvent ainsi être envisagés au cours d'une réaction. Des mécanismes de réaction sont proposés pour expliquer la cinétique et le mélange produit relatif d'une réaction. De nombreux chimistes physiques se spécialisent dans l'exploration et la proposition des mécanismes de diverses réactions chimiques. Plusieurs règles empiriques, comme celles de Woodward-Hoffmann, sont souvent utiles tout en proposant un mécanisme de réaction chimique. Selon le livre d'or de l'IUPAC, une réaction chimique est un processus qui conduit à l'interconversion des espèces chimiques". Par conséquent, une réaction chimique peut être une réaction élémentaire ou une réaction par étapes. Une autre mise en garde est faite, en ce sens que cette définition inclut les coques où l'interconversion des conformères est observable expérimentalement. De telles réactions chimiques détectables impliquent normalement des ensembles d'entités moléculaires, comme l'indique cette définition, mais il est souvent pratique d'utiliser le terme aussi pour des changements impliquant des entités moléculaires uniques (c.-à-d. "événements chimiques microscopiques"). Equilibrium Article principal : Équilibre chimique Bien que le concept d'équilibre soit largement utilisé dans les sciences, dans le contexte de la chimie, il se présente chaque fois qu'un certain nombre d'états différents de la composition chimique sont possibles. Par exemple, dans un mélange de plusieurs composés chimiques qui peuvent réagir les uns avec les autres, ou lorsqu'une substance peut être présente dans plus d'une phase. Un système de substances chimiques à l'équilibre, même si la composition est la plupart du temps immuable, n'est pas statique ; les molécules des substances continuent de réagir les unes avec les autres, donnant ainsi lieu à un équilibre dynamique. Ainsi, le concept décrit l'état dans lequel les paramètres tels que la composition chimique restent inchangés au fil du temps. Les produits chimiques présents dans les systèmes biologiques ne sont pas toujours en équilibre, mais ils sont loin d'être en équilibre. Énergie Article principal : Énergie Dans le contexte de la chimie, l'énergie est un attribut d'une substance en raison de sa structure atomique, moléculaire ou agrégée. Étant donné qu'une transformation chimique s'accompagne d'un changement dans une ou plusieurs de ces structures, elle s'accompagne invariablement d'une augmentation ou d'une diminution de l'énergie des substances concernées. Une partie de l'énergie est transférée entre l'environnement et les réactifs de la réaction sous forme de chaleur ou de lumière; ainsi les produits d'une réaction peuvent avoir plus ou moins d'énergie que les réactifs. On dit qu'une réaction est exogène si l'état final est plus faible à l'échelle de l'énergie que l'état initial; dans le coque des réactions endergoniques, la situation est l'inverse. On dit qu'une réaction est exothermique si la réaction libère de la chaleur dans l'environnement; dans le coque des réactions endothermiques, la réaction absorbe la chaleur de l'environnement. Les réactions chimiques ne sont pas toujours possibles à moins que les réactifs surmontent une barrière d'énergie connue sous le nom d'énergie d'activation. La vitesse d'une réaction chimique (à une température donnée T) est reliée à l'énergie d'activation E, par le facteur de population e - E / kT de Boltzmann, c'est-à-dire la probabilité que la molécule ait une énergie supérieure ou égale à E à la température donnée T. Cette dépendance exponentielle d'un taux de réaction à la température est connue sous le nom d'équation Arrhenius. L'énergie d'activation nécessaire à une réaction chimique peut être sous forme de chaleur, de lumière, d'électricité ou de force mécanique sous forme d'échographie. Un concept connexe d'énergie libre, qui intègre également des considérations d'entropie, est un moyen très utile pour prédire la faisabilité d'une réaction et déterminer l'état d'équilibre d'une réaction chimique, en thermodynamique chimique. Une réaction n'est possible que si le changement total dans l'énergie libre de Gibbs est négatif, si elle est égale à zéro, la réaction chimique est dite à l'équilibre. Il n'existe que des états d'énergie limités pour les électrons, les atomes et les molécules. Celles-ci sont déterminées par les règles de la mécanique quantique, qui nécessitent la quantification de l'énergie d'un système lié. On dit que les atomes/molécules dans un état d'énergie plus élevé sont excités. Les molécules/atomes de substance dans un état d'énergie excité sont souvent beaucoup plus réactifs, c'est-à-dire plus sensibles aux réactions chimiques. La phase d'une substance est toujours déterminée par son énergie et l'énergie de son environnement. Lorsque les forces intermoléculaires d'une substance sont telles que l'énergie de l'environnement n'est pas suffisante pour les surmonter, elle se produit dans une phase plus ordonnée comme liquide ou solide comme le coque avec l'eau (H2O); un liquide à température ambiante parce que ses molécules sont liées par des liaisons hydrogène[43]. Alors que le sulfure d'hydrogène (H2S) est un gaz à température ambiante et à pression standard, ses molécules étant liées par des interactions dipôle-dipôle plus faibles. Le transfert d'énergie d'une substance chimique à une autre dépend de la taille de l'énergie quanta émise par une substance. Toutefois, l'énergie thermique est souvent transférée plus facilement de presque n'importe quelle substance à une autre parce que les phonons responsables des niveaux d'énergie vibrationnelle et rotationnelle dans une substance ont beaucoup moins d'énergie que les photons invoqués pour le transfert électronique d'énergie. Par conséquent, comme les niveaux d'énergie vibrationnelle et rotationnelle sont plus espacés que les niveaux d'énergie électronique, la chaleur est plus facilement transférée entre les substances par rapport à la lumière ou à d'autres formes d'énergie électronique. Par exemple, le rayonnement ultraviolet électromagnétique n'est pas transféré avec autant d'efficacité d'une substance à une autre que l'énergie thermique ou électrique. L'existence de niveaux d'énergie caractéristiques pour différentes substances chimiques est utile pour leur identification par l'analyse des raies spectrales. Différents types de spectres sont souvent utilisés dans la spectroscopie chimique, par exemple IR, micro-ondes, RMN, ESR, etc. La spectroscopie est également utilisée pour identifier la composition des objets éloignés - comme les étoiles et les galaxies lointaines - en analysant leurs spectres de rayonnement. Le terme énergie chimique est souvent utilisé pour indiquer le potentiel d'une substance chimique à subir une transformation par réaction chimique ou à transformer d'autres substances chimiques.
Traduction automatique
Avis des clients
4.5 sur 5 étoiles136 Nombres de Commentaires
136 Commentaires
Avis sur des produits similaires
5 sur 5 étoiles
Par hermann m.18 mars 2023 • Achat sécurisé
Programme d'évaluation de Zazzle
Ce produit est très beau et donne un bel aperçu des îles Féroé. Dommage pour la livraison, le livreur s'est trompé d'adresse heureusement qu'il y a des personnes honnêtes pour vous rapporter votre colis sinon déclaré perdu..... Paysage très beau et très représentatif.
1 sur 5 étoiles
Par Anonyme16 décembre 2024 • Achat sécurisé
Commande non reçue à ce jour .
5 sur 5 étoiles
Par hermann m.18 mars 2023 • Achat sécurisé
Programme d'évaluation de Zazzle
J'aime beaucoup ce porte-clé mais je regrette que le livreur se soit trompé d'adresse, heureusement que la personne qui l'a reçue, s'est dérangée pour me le rapporter. Le porte clé est très beau.
Tags
Autres infos
Identification produit : 146259710441158957
Créé le : 10/04/2012 14:02
Note : G
Articles vus récemment